| Page Index |
|
(情報BOX) |
|
|
|
(用語解説・辞書) |
|
|
|
(各種標準):医薬品の研究開発、医療の分野で使用されている標準・ガイドラインを紹介しています |
|
|
|
(コンピュータシステムの品質管理標準:別ページへジャンプ) |
|
|
|
(日米欧の規制整合組織) |
|
|
| |
| 情報BOX |
|
医薬品の研究開発関係 |
|
国際共同試験に関する諸問題 データ標準化の観点から 2007年計量生物セミナー資料、2007年12月
データ標準が全てのデータプロセスの根幹になる
|
グローバル開発に向けた臨床試験の品質と効率化を考える 日本製薬工業協会 統計・DM 部会シンポジウム、2007年5月
━ 新たな臨床試験システムと標準化 ━
|
「遺伝学的検査の信頼性・互換性向上及び標準化に関する調査研究」報告書 財 バイオインダストリー協会、2007年4月6日
本調査研究では、自国産業の競争優位を目指す米国企業群の取り組みに対峙して、我が国独自の発案による標準物質の開発・普及を図るべく、我が国の臨床検査機械システム産業の欧米諸国との技術的差別化及び市場優位性、及びヒト遺伝子発現解析データの相互比較の可能性に関して調査・検討し、これらの調査・検討結果、及び専門家で構成される委員会における討議・審議結果等を踏まえて、遺伝子発現解析検査に関連する検査機械システム市場の世界的な創生・拡大及び健全な発展を図るために我が国が戦略的に取り組むべき課題を明らかにし、本調査研究の目的である核酸標準物質(参照物質)の具体的な開発方法を取りまとめた。
|
バイオインフォマティクスにおける標準化 社団法人 バイオ産業情報化コンソーシアム、2003年3月
、今回のバイオインフォマティクスにおける標準化対応システムに関するフィージビリティスタディでは、標準化委員会(委員長 国立遺伝学研究所 生命情報・DDBJ研究センタ長
教授 五條堀 孝氏)を設置し、また、作業グループとして標準化フィージビリティスタディ・ワーキンググループを設置して世界の標準化動向を把握するとともに、標準化案の検討、及び標準化対応プロトタイプシステムの開発を経て日本発の標準化案を策定し、国際標準化推進団体へ提案することとなりました。
|
臨床試験におけるデータの標準化について(『治験IT化の現状と課題』研究班報告より) 関西SASUser会、2006年5月
|
臨床試験における統計解析プロセスの標準化 関西SASUser会、2003年5月
|
|
|
|
|
医療関係 |
|
医療機器における情報化推進状況調査について 厚生労働省、2009年3月
医療機器の情報化に関しては、平成11年3月に日本医療機器関係団体協議会(現在の日本医療機器産業連合会(以下、「医機連」という。))により、国際整合性の観点から、商品コードとしてはJAN商品コードが、バーコードとしてはUCC/EAN−128体系がそれぞれ業界の標準仕様として決定されている。これを受け、厚生労働省としても、バーコードモデル事業等によりその普及を推進してきたところである。
今般、昨年度に引き続き医機連(今年度より、日本臨床検査薬協会(以下、「臨薬協」という。)を追加)により、「医療機器における情報化推進状況調査」が実施され、結果がとりまとめられたので、その概要を以下のとおり公表する。
|
医療用医薬品における情報化進捗状況調査について 厚生労働省、2009年3月
医療用医薬品のコード表示標準化に関しては、「医療用医薬品へのバーコード表示の実施について」(平成18年9月15日付け薬食安第0915001号)(以下、「通知」という。)により各製造販売業者が適正にバーコード表示を行うよう通知され、これに基づく各企業の取組が進められてきたところである。また、「新医薬品産業ビジョン」のアクションプランにおいては、流通機能の効率化・高度化に向けてIT化・標準化のさらなる推進を促していくこととされている。
今般、日本製薬団体連合会及び日本医薬品卸業連合会の協力により、「医療用医薬品における情報化推進状況調査」が実施され、結果がとりまとめられたので、その概要を以下のとおり公表する。
|
医療情報システムの安全管理に関するガイドライン(第2 版) 厚生労働省、2007年3月
平成11年4月の「法令に保存義務が規定されている診療録及び診療諸記録の電子媒体による保存に関する通知」及び、平成14年3月通知「診療録等の保存を行う場所について」に基づき作成された各ガイドラインを統合したものです。
|
医療用具技術分野における国際標準化活動基盤強化アクションプラン各論(改訂版) 日本工業標準調査会(JISC)、2006年4月
薬事法では、製品の各国間相互認証を視野に入れ、低リスクの医療機器への第三者認証制度の導入において、JISを引用した認証基準の国際整合性の確保を強く求めている。この背景を踏まえ、国際規格の作成、改正の審議段階から積極的に我が国の意見の反映し、当初から整合化した国際規格の作成に配慮している。
|
「標準的電子カルテ推進委員会」最終報告について 厚生労働省、2005年5月17日
厚生労働省においては、平成15年8月より、医政局長の私的検討会「標準的電子カルテ推進委員会」を設置し、厚生労働科学研究事業にて実施された標準的電子カルテ開発に関連する研究の成果等を踏まえながら、標準的電子カルテシステムに求められる共通の機能や基本要件、運用管理のあり方、今後の適切な 普及方策等について検討を行ってきました。
|
今後の医療情報ネットワーク基盤のあり方について 厚生労働省、2004年9月30日
医療情報ネットワーク基盤検討会 最終報告。
今後の望ましい医療情報ネットワークの構築に向けた制度基盤等について検討を行い、保健医療福祉分野の公開鍵基盤、書類の電子化及び診療録等の電子保存の主要検討課題を中心に、最終報告を取りまとめた
|
|
|
|
|
全般 |
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
| 医薬品の研究開発、医療の分野で使用されている標準・ガイドラインを紹介しています |
|
|
|
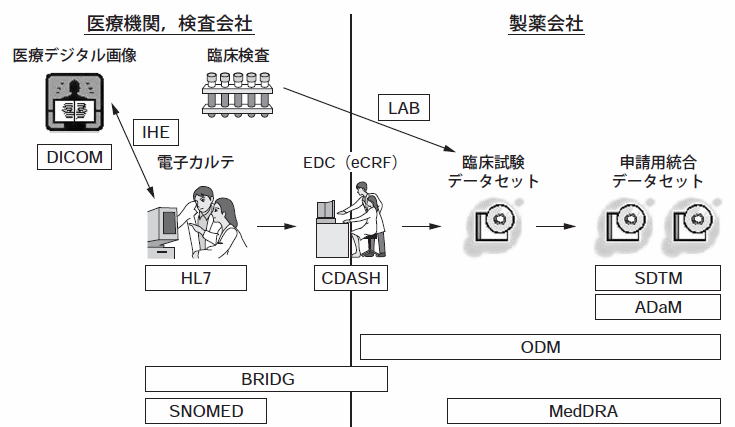
CDISC(Clinical Data Interchange Standards Consortium)は、医薬品・バイオ医薬品開発における臨床試験データ及びメタデータの電子的な獲得、交換、申請、保存(アーカイブ)を支援する世界的な業界標準の開発に取り組む公開された学際的非営利団体です。、2000年に組織され、その活動は、米国を起点にヨーロッパ、日本およびインドに広がり、各地において地域グループが活動を行っています。
CDISCは現在、その役割や対象に応じてSDTMを含む複数のモデルを有していますが、将来的には、既存の全てのCDISCモデルを1つのCDISC標準として集約することを目指しています。また、さらにその後は、電子カルテのような患者データや生物医学研究のシステムとのデータ相互運用を可能にする、生物医学研究との統合ドメイングループ構築モデル(Biomedical Research Integrated Domain Group、「BRIDG」)の下にさらに統合していく予定です。BRIDGは、FDAやNCI(国立癌研究所)との共同プロジェクトです。
医薬品並びにバイオ医薬品の開発における臨床試験や非臨床試験のデータおよびメタデータの電子的な取得・交換・申請ならびにアーカイブを支援する世界的な業界標準と、関連する文書およびインプリメンテーションガイドは、全てCDISCウェブサイト
(www.cdisc.org) の”Standards”から無料で入手することができます。
|
|
 |
|
臨床薬理 Japan J Clin Pharmacol Ther 39(2) Mar 2008 |
|
|
|
| 標準 |
解説 |
| 電子申請データ仕様 |
SDTM
(Submission Data Tabulation Model )
SEND
(Standard Exchange for the nonclinicalData ) |
SDTMは臨床試験データ、SEND)は非臨床(動物)試験データのcase report tabulations(CRT)として規制当局への申請に用いられています。 |
ADaM
(Analysis Dataset Model ) |
ADaMチームは解析データセットを規制当局へ提出するためにSDTMと一貫したGeneral Considerations documentを発行しました。数種の解析手法に特化したデータセットの例示が含まれています。 |
CRT-DDS
*Case Report Tabulation and Data Definition Specification |
Define.xmlはODM XML transport standardにおいて規制当局への申請のためのデータ説明文書(メタデータ)を作成する方法を記述するために用いられています。 |
| 通信規約 |
ODM
(Operational Data Model ) |
ODM(CDISC transport Standard)はオペレーショナルデータのトランスポート、電子データのアーカイブおよびDefine.xmlとして試験データの申請に用いられています。 |
LAB
(Clinical Laboratory Model) |
LAB model (content standard)は臨床検査機関および試験依頼者間のデータの交換に用いられています。この標準は、XML,
ASCII, SASまたはHL7 V3メッセージを含む様々なフォーマットで実装されています。 |
| 治験内容の定義 |
| PR(Protocol Representation) |
治験のプロコルを記述し、HISに渡すという規格。HL7との共同作業で進められています。 |
CDASH
(Clinical Data Acquisitions Standards Harmonization) |
CRFの標準化をねらって作成されています。
CDISC Announces the Publication of CDASH version 1.0
|
| その他 |
BRIDG
(Biomedical Research Integrated Domain Group Model) |
HL7とCDISC間の相互利用を目的とした架け橋
URL:http://www.bridgproject.org
|
SCTP
(Structured Clinical Trial Protocol) |
このプロトコールを表示するための標準は、HL7, CDISC, NCI, FDAおよびその他の団体との共同作業によるもので、システムおよび関係者間でのプロトコールデータの交換を可能にする、人および機械によって可読なモデルを開発するために作られたものです。試験デザインおよび他の部分はSDTM
content に基づいています。 |
|
|
|
|
(参考情報) |
|
|
|
|
|
(サイト情報) |
|
|
|
|
|
|
|
独立したシステム間での互換性と相互運用性を達成するため、また比較統計(分類等)のためのデ−タの互換性を保証し、努力の重複や冗長性をなくすため、保健医療情報及び保健医療情報通信技術(Health Information and Communications Technology)の標準化を図っています。 MEDIS-DC HPより
国際標準化機構(ISO:International Organization for Standardization)の技術委員会(TC:Technical
Committee)215に対応した、ISO/TC 215国内対策委員会については、(財)医療情報システム開発センターが事務局となり、技術委員会の検討課題に対する意見等の調整を行っています。 |
|
WG! データ構造
WG2 データ交換
WG3 意味コンテンツ
WG4 セキュリティ
WG5 ヘルス・カード
WG6 ファーマシと医薬品ビジネス
WG7 デバイス
WG8 電子カルテ(EHR)の要件
|
| 公開済みISO標準 開発中の標準 |
|
|
|
|
|
|
IHE(Integrating Healthcare Enterprise)は、医療連携のための統合化プロジェクト。IHE-J(Japan)で日本向け運用に拡張し、多くの施設が使える日本適合型ガイドラインとして公開しています。IHE-J(Japan)は、規格の使い方を提案しているガイドラインで、HL7やDICOMを標準規格としています。
IHEの日本版であるIHE-Jでは、(社)日本画像医療システム工業会(JIRA)が管理事務局となって運営委員会のもとに放射線部門情報システムの相互接続性の推進だけでなく、病理、内視鏡、超音波、循環器分野への適用も着実に進めています。 |
|
|
|
|
|
|
|
医療情報交換のための標準規約で、患者管理、オーダ、照会、財務、検査報告、マスタファイル、情報管理、予約、患者紹介、患者ケア、ラボラトリオートメーション、アプリケーション管理、人事管理などの情報交換を取り扱います。
HL7はHealth Level Sevenの略で、「医療情報システム間のISO-OSI第7層アプリケーション層」に由来しています。米国のHL7協会本部では数多くの技術委員会を組織し新しい標準の研究・作成を行っており、会員(米国及び国際支部国)の承認後発行されます。
日本においても大学病院などのシステム化や各種の標準化活動において本標準が採用されています。 |
|
|
|
|
|
|
|
MMLは、異なる医療機関(電子カルテシステム)の間で、診療データを正しく交換する為に考えられた規格です。最新バージョンのMMLはXML技術を用いて開発されています。 |
|
|
|
|
|
|
|
DICOM(Digital Imaging and COmmunication in Medicine)は、米国放射線学会(ACR)と北米電子機器工業会(NEMA)が開発した医用画像と通信の標準規格です。日本では、医用画像機器の業者の団体である日本放射線機器工業会(JIRA)で医用画像と通信の標準規格として採用されています。DICOMはダイコムと発音します。 |
|
|
|
|
|
|
|
医薬品の有効性・安全性に関する情報をSGML(またはXML)を利用した文書型定義(PML)に基づいて電子化することを目指して開発を行っています。任意団体のPML研究会が活動しています。 |
|
|
|
|
|
|
|
IMES(アイムス/Inter-Mediate Electronic Standard) は、製薬協が推進する中間標準です。
汎用構造型XML定義文を中間標準とし、タグをXMLの要素としています。そのため柔軟性・拡張性に優れています。 |
|
|
|
|
|
副作用関連で業界でよく使われている辞書には次のようなものがあります。 |
|
MedDRA/J((The Medical Dictionary for Regulatory Activities Terminology):医学用語集)
MedDRAは日米欧医薬品規制ハーモナイゼーション国際会議(ICH)での検討の結果、開発された医学用語集で、日本国内をはじめ欧米でも医薬品規制の場で広く利用が開始されています。このMedDRAの日本語版が「ICH国際医薬用語集日本語版(MedDRA/J)」です。
医薬品副作用・感染症症例報告書への記入については厚生労働省によってMedDRA/Jの使用が推奨されており、またこれらのデータの電子的報告についてはMedDRA/Jの使用が必須となっています。
|
J-ART(Japanese Adverse Drug Reaction Terminology):医薬品副作用用語集
WHO-ARTを基に作成された日本の副作用用語集
厚生労働省通知、医薬安第1 6 4 号、医薬審第1 8 4 3 号により、J-ART に代わり日本語版MedDRA に収載されている医薬品副作用等用語を使用することを推奨されています。
|
WHO-ART(WHO Adverse Drug Reaction Terminology):医薬品副作用用語集
世界保健機構が作成・管理している有害事象の用語集
|
COSTART(Coding Symbols for Thesaurus of Adverse Reacion Terms):FDA
米国FDAが提供している有害事象の用語集
|
HARTS
ヘキスト副作用用語集 |
|
|
|
|
|
|
疾病関連で業界でよく使われている辞書には次のようなものがあります。 |
|
ICD-10 WHO
「疾病及び関連保健問題の国際統計分類:International Statistical Classification of Diseases
and
Related Health Problems(ICD)」とは、異なる国や地域から、異なる時点で集計された死亡や疾病の
データの体系的な記録、分析、解釈及び比較を行うため、世界保健機関憲章に基づき、
世界保健機関(WHO)が作成した分類。
最新の分類は、ICDの第10回目の修正版として、1990年の第43回世界保健総会において
採択されたものであり、ICD−10(1990)と呼ばれている。
疾病、傷害及び死因分類 厚生労働省
|
標準病名マスター(MEDIS病名ファイル) 財団法人医療情報システム開発センター(MEDIS-DC)
ICD10対応電子カルテ用標準病名マスター
|
| MedDRA/J |
|
|
|
|
|
|
医薬品関連で業界でよく使われている辞書には次のようなものがあります。 |
|
医療用医薬品データファイル(コード表) 発行:医薬情報研究所 編集:MT協議会
副作用報告および再審査報告用医薬品名コード
4月末と8月末の年2回、全件を磁気媒体で提供
|
WHO-Drug Dictionary
|
標準医薬品マスター 財団法人医療情報システム開発センター(MEDIS-DC)
医薬品マスター(HOT番号)
|
薬価基準収載医薬品コード 厚生労働省医政局経済課
薬価基準収載医薬品に付けられる12桁(アルファベット1字を含む)の数字です。
医薬品の成分、剤形、銘柄等を表します。
|
個別医薬品コード(YJコード) 医薬情報研究所
薬価基準収載医薬品コードは,薬価基準の告示 1つに対して1つ付与されます。よって,統一名収載品目の
場合は告示される一般名に対して 1つ付与されており,実際の商品名が複数あっても 1つのコードになります。
そこでコードで品目管理するため,統一名収載品目の個々の商品にも別々のコードを付与したものが
個別医薬品コードです。薬価基準収載医薬品コードと個別医薬品コードが別コードになるのは
統一名収載品目のみになります。
厚生労働省の添付文書情報提供サービスの医薬品コードとしての利用、薬価情報を迅速に取り込むための
キーコードとして広く利用が定着しています。
|
JANコード JIS
バーコードの下に記載されている番号です。
日本工業規格(JIS)が制定するバーコードで、アメリカやヨーロッパ等各国と互換性のある国際的な
規格コードです。
医薬品の場合、統一商品コードの頭に4987をつけたものがJANコードになります。
|
レセプト電算処理システム用コード 厚生労働省保険局保険課
厚生省レセプト電算処理システムに参加する医療機関が審査支払機関に提出する磁気レセプトにおいて
使用する9桁のコード。コードの構成: 区分(1桁)、医薬品ごとに設定された番号(8桁)
|
JAPICコード
日本医薬情報センター(Japan Pharmaceutical Information
Center:JAPIC)が付けているコードです。
同センターが提供する医薬品情報の検索等に用いられる。
|
統一商品コード
医薬品のメーカー名、販売包装単位等を表すコードです。 |
|
|
|
|
|
|
|
|
|
|
|
|
| 受託業務の適正な実施に関する日本CRO協会の自主ガイドライン |
| トクホのヒト試験に関する自主ガイドライン |
| 「CROとSMOの取り組み方−CROとSMOの適正なあり方について−」 |
| 「モニタリング業務の実施に係わる治験業務委託契約(モデル契約書)(案)」 |
|
|
|
|
|
|
|
|
|
|
|
|
特定健診の実施に際して、診療機関から外注臨床検査機関に対し依頼された臨床検査の検
査結果を、電子的に交換するための標準フォーマットを定めたもの
特定健診検査結果データ交換
|
|
|
|
|
|
|
|
|
|
|
|
日・米・EUの3極間で、新医薬品の製造(輸入)承認に際して要求される資料を共通化することによって、医薬品開発の迅速化・効率化を目指そうという会議です。ICHの会議によって協議・合意決定された取り決め事項を「ICHガイドライン」と呼び、日米EUでの医薬品開発におけるガイドラインとしての役目を果たします。ICHは91年の発足以来、3極(日・米・EU)の持ち回りで2〜3年に1回のペースで開かれています。
ガイドラインがICHで合意(調和)に至ると、そのガイドラインを適用した医薬品開発や臨床試験、医薬品申請が各地域で可能となるよう、各国が法的な整備も含めた必要な措置を取ります。日本では、ICHで合意されたガイドラインは厚生労働省医薬食品局から通知されます。
|
|
ICHについての情報 |
|
|
|
|
|
Topics |
|
|
|
|
|
|
|
HBD(Harmonization By Doing)は、日米における医療機器に関する規制について、実践を通して整合化を図ることを目的とした、日米の官・学・民による共同の活動です。
日米の 官・学・民 として、次の組織が参画しています。
○ 官:厚生労働省/独立行政法人医薬品医療機器総合機構、米国食品医薬品局(FDA)
○ 学:日本の関連学会、日本国内の大学や医療機関の先生方、Duke大学
○ 民:日本医療機器産業連合会(医機連)、米国先進医療技術工業会(AdvaMed) |